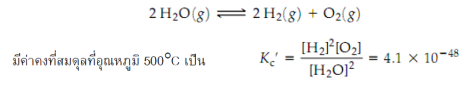นาย รัชชานนท์ ศิริยงค์
นาย ธัญวัชร์ ภู่จ้อย
นาย วศิน เอี่ยมอ่อนตา
นาย ธวัชพล บุญมา
สมดุลเคมี (Chemical Equilibrium)
ปฏิกิริยาเคมีส่วนใหญ่เป็นปฏิกิริยาที่ดำเนินไปทิศทางเดียวคือจากสารตั้งต้นเปลี่ยนแปลงไปเป็นผลิตภัณฑ์และเกิดขึ้นอย่างสมบูรณ์ เช่น การเผาไหม้น้ามันเชื้อเพลิง เป็นต้น ปฏิกิริยานี้จัดเป็นปฏิกิริยาที่ผันกลับไม่ได้ (Irreversible reaction) แต่เราก็จะมักพบเสมอว่าบางปฏิกิริยาไม่ดาเนินไปจนเสร็จสมบูรณ์ หมายความว่าตัวทาปฏิกิริยาทั้งหมดไม่ได้เปลี่ยนไปเป็นผลปฏิกิริยา ยังคงเหลือตัวทาปฏิกิริยาอยู่ ปฏิกิริยาเช่นนี้เรียกว่าปฏิกิริยาที่ผันกลับได้ (Reversible reaction)
มักพบเสมอว่าบางปฏิกิริยาไม่ดาเนินไปจนเสร็จสมบูรณ์ หมายความว่าตัวทาปฏิกิริยาทั้งหมดไม่ได้เปลี่ยนไปเป็นผลปฏิกิริยา ยังคงเหลือตัวทาปฏิกิริยาอยู่ ปฏิกิริยาเช่นนี้เรียกว่าปฏิกิริยาที่ผันกลับได้ (Reversible reaction)
1. การเปลี่ยนแปลงที่ผันกลับได้
การเปลี่ยนแปลงที่ผันกลับได้ หมายถึง การเปลี่ยนแปลงที่เมื่อเปลี่ยนแปลงไปแล้วสามารถกลับคืนสู่สภาพเดิมได้อีก หรือ หมายถึงการเปลี่ยนแปลงที่มีทั้งการเปลี่ยนแปลงไปข้างหน้าและการเปลี่ยนแปลงย้อนกลับ เช่นตัวอย่างของปฏิกิริยาเคมีที่ผันกลับได้
2. ภาวะสมดุล
เมื่อสารทาปฏิกิริยากัน ที่ภาวะสมดุลจะมีทั้งสารที่เข้าทาปฏิกิริยา (reactant) และผลผลิต (product) ภาวะสมดุล (equilibrium state) เกิดขึ้นเมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า (forward reaction ) เท่ากับอัตราการเกิดปฏิกิริยาย้อนกลับ (reverse reaction ) ถ้าในระบบที่พิจารณาถ้าปฏิกิริยาเปลี่ยนไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา เรียกว่า สมดุลพลวัต หรือสมดุลไดนามิก (dynamic equilibrium) เขียนแทนด้วยลูกศรไป-กลับ
2.1 ภาวะสมดุลระหว่างสถานะ
สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย
เราสามารถสังเกตจากสีที่คงที่ หรือ สถานะของสารคงที่ดูเสมือนไม่เกิดการเปลี่ยนแปลง แต่ความจริงแล้วระบบมิได้หยุดนิ่งและมีการเปลี่ยนแปลงตลอดเวลาเรียกการเกิดสภาวะแบบนี้ว่า “สมดุลไดนามิก” ดังนั้นภาวะสมดุลระหว่างสถานะ ก็เป็นสมดุลไดนามิก
2.2 ภาวะสมดุลในสารละลายอิ่มตัว
เมื่อให้ตัวถูกละลาย ละลายในตัวทาละลาย ตัวถูกละลายก็จะละลายได้เร็วในตอนแรกแล้วละลายได้ช้าลงและเมื่อเกิดสารละลายอิ่ม ตัว เราจะพบว่าตัวถูกละลายไม่ละลายต่อไปอีกไม่
ว่าจะคนสารละลายเป็นเวลานานเท่าใดถ้าอุณหภูมิคงที่ เช่น การนาเกลือแกง (NaCl) มาละลายน้า จนได้สารละลาย และละลายต่อจนได้สารละลายอมิ่ ตัว เมื่อตั้งสารละลายอมิ่ ตัวไว้จะเกิดผลึกของ NaCl เกิดขึ้น แล้วจะมีปริมาณเพมิ่ ขึ้นเรื่อยๆจนในที่สุดผลึกคงที่ เรายังดูเหมือนว่าไม่เกิดผลึกอีก แต่ในระบบผลึกยังคงเกิดขึ้นเรื่อยๆ แล้วก็ละลายในสารละลายอีกด้วย ดังนั้น ภาวะสมดุลในสารละลายอมิ่ ตัวก็เป็นสมดุลไดนามิก
2.3 ภาวะสมดุลในปฏิกิริยาเคมี
ภาวะสมดุลในปฏิกิริยาเคมีเกิดขึ้นได้ก็ต่อเมื่อเป็นปฏิกิริยาผันกลับได้และเกิดปฏิกิริยาในระบบปิด โดยระบบ แบ่งออกเป็น
1) ระบบเปิด (Opened system) คือระบบที่มีการถ่ายเทได้ทัง้ มวลสารและพลังงานกับสิ่ง แวดล้อม
2) ระบบปิด (Closed system) คือระบบที่มีการถ่ายเทเฉพาะพลังงานอย่างเดียว แต่ไม่มีการถ่ายเทมวลสาร
3) ระบบโดดเดี่ยว (Isolated system) คือระบบที่ไม่มีการถ่ายเททัง้ พลังงานและมวลสารแก่สิ่งแวดล้อม
ถ้าเริ่ม ต้นเราใส่ CO จา นวน 1.0 โมล และ H2 จา นวน 3.0 โมล ลงในภาชนะขนาด 10.0ลิตร ที่ 1200 K อัตราการเกิดปฏิกิริยาระหว่าง CO กับ H2 ขึ้นกับความเข้มข้นของ CO และ H2คือ ตอนแรกๆ สารทั้งสองชนิดมีความเข้มข้นมาก แต่เมื่อสารทำปฏิกิริยากัน ความเข้มข้นจะลดลงเรื่อยๆ นั่น คือ อัตราการเกิดปฏิกิริยาจะสูงในช่วงแรกๆ แล้วจะค่อยๆลดลง ในขณะที่ความเข้มข้นของผลผลิต (ที่มีค่าเท่ากับศูนย์ในตอนแรก) จะค่อยๆเพิ่ม ขึ้น และมีค่าคงที่เมื่อถึงภาวะสมดุล หรือกล่าวได้อีกอย่างหนึ่งว่า ตอนแรกๆอัตราการเกิดปฏิกิริยาย้อนกลับมีค่าเป็นศูนย์แล้วค่อยๆ เพิ่ม ขึ้นจนเท่ากับอัตราการเกิดปฏิกิริยาไปข้างหน้า เมื่อถึงสมดุล ที่ภาวะสมดุล ความเข้มข้นของสารต่างๆ มีค่าคงที่ และเราจะไม่เห็นการเปลี่ยนแปลงใดๆ อีกถึงแม้ว่าปฏิกิริยายังคงดาเนินไป
ดังนั้น ในปฏิกิริยาใดจะเกิดสมดุลได้จะต้อง
1. เกิดในระบบปิด
2. มีสมดุลไดนามิก
3. ยังมีสารตั้ง ต้นเหลืออยู่
4. ระบบสามารถเข้าสู่สมดุลได้ไม่ว่าจะเรมิ่ ต้นจากไปข้างหน้าหรือย้อนกลับ
5. เกิดการเปลี่ยนแปลงที่ผันกลับได้
6. ความเข้มข้น, ความดัน และ อุณหภูมิมีผลต่อภาวะสมดุล
3. การดา เนินเข้าสู่ภาวะสมดุลของระบบ
การดาเนินเข้าสู่สภาวะสมดุลของระบบไม่ขึ้นอยู่กับทิศทาง ไม่ว่าจะเริ่มจากการเปลี่ยนแปลงไปข้างหน้าหรือเริ่ม จากการเปลี่ยนแปลงย้อนกลับ เมื่อระบบเข้าสู่สมดุล ภาวะสมดุลที่เกิดขึ้นจะมีลักษณะเหมือนกันทุกประการการเขียนกราฟแสดงการเกิดภาวะสมดุล เขียนได้สองลักษณะ คือ
2. เขียนกราฟแสดงความสัมพันธ์ระหว่างความเข้มข้นของสารกับเวลา
ก. ที่ภาวะสมดุลที่เวลา t1 ความเข้มข้นของสาร A มากกว่าความเข้มข้นของสาร B
(ความเข้มข้นของสารตัง้ ต้นมากกว่าความเข้มข้นของผลิตภัณฑ์)
ข.ที่ภาวะสมดุลที่เวลา t1 ความเข้มข้นของสาร A น้อยกว่าความเข้มข้นของสาร B
(ความเข้มข้นของสารตั้ง ต้นน้อยกว่าความเข้มข้นของผลิตภัณฑ์)
ค. ที่ภาวะสมดุลที่เวลา t1 ความเข้มข้นของสาร A เท่ากับความเข้มข้นของสาร B
(ความเข้มข้นของสารตั้ง ต้นเท่ากับความเข้มข้นของผลิตภัณฑ์)
4. สมดุลในปฏิกิริยาเคมี
4.1 ค่าคงที่สมดุล
กฎของภาวะสมดุลทางเคมี (Law of Chemical Equilibrium) กล่าวว่า “ สำหรับปฏิกิริยาที่ผันกลับได้ ที่ภาวะสมดุล ผลคูณของความเข้มข้นของสารผลิตภัณฑ์ เมื่อหารด้วยผลคูณของความเข้มข้นของสารตั้ง ต้นที่เหลือ โดยที่ความเข้มข้นของสารแต่ละชนิดยกกำลังด้วยเลขสัมประสิทธิ์บอกจา นวนโมลของสารในสมการที่ดุลแล้วจะมีค่าคงที่เสมอเมื่ออุณหภูมิคงที่”
หากภาวะสมดุลที่เกิดขึ้นในปฏิกิริยาที่มีสารอยู่ในวัฏภาคเดียวกันทั้งหมดจะเรียกว่าสมดุลเอกพันธ์ (Homogeneous reaction) สาหรับปฏิกิริยาที่เกิดขึ้นที่สารตั้งต้นและสารผลิตภัณฑ์มีวัฏภาคแตกต่างกัน เรียกว่าสมดุลวิวิธภัณฑ์ (Heterogeneous reaction) ถ้าสารทีเกี่ยวข้องในปฏิกิริยา มีของแข็งหรือของเหลวทีบ่ ริสุทธริ์ วมอยู่ด้วย ไม่ต้องนาความเข้มข้นของสารทีเ่ ป็นของแข็งหรือของเหลวบริสุทธิ์ มาเขียนไว้ในอัตราส่วนทีแสดงค่าคงที่ของสมดุล เพราะสารทีเป็นของแข็งและของเหลวบริสุทธิ์จะมีความเข้มข้นคงที่ เช่น
– ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล (K)
1. ค่า K ขึ้นอยู่กับอุณหภูมิ คือ เมื่ออุณหภูมิคงที่ ค่า K ก็จะคงที่ แต่ถ้าอุณหภูมิเปลี่ยน ค่า Kก็จะเปลี่ยนด้วย ดังนั้น เมื่อกล่าวถึงค่า K ต้องอ้างอุณหภูมิเสมอ
2. ค่า K ในปฏิกิริยาต่างชนิดกันส่วนใหญ่จะมีหน่วยต่างกัน และบางปฏิกิริยาไม่มีหน่วยขึ้นกับสถานะของสาร
3. ค่า K ขึ้นอยู่กับลักษณะของสมการที่เขียน คือ ถ้าเขียนสัดส่วนของจานวนโมลของสารตั้งต้นและสารผลิตภัณฑ์ในสมการต่างกัน ค่า K ไม่เท่ากัน ดังนั้นเมื่อกล่าวถึงค่า K จะต้องอ้างอิงถึงสมการด้วยเสมอ
ดังนั้นสรุปได้ว่า
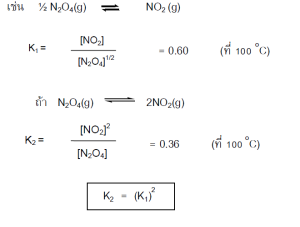
1) ถ้ากลับสมการ ค่า K จะกลับเศษเป็นส่วน
2) ถ้านาสมการมารวมกัน ค่า K จะนามาคูณกัน
3) ถ้าเอาเลขคูณทั้ง สมการ ค่า K นามายกกาลังเลขนั้น
4) ถ้านาสมการมาลบกัน ค่า K จะนามาหารกัน
หลักการคา นวณหาค่า K เพื่อทราบความเข้มข้นของสาร
1.เขียนสมการของปฏิกิริยาพร้อมดุลสมการนั้น
2.หาจา นวนโมลหรือ โมล/ลิตร เมื่อเรมิ่ ต้นปฏิกิริยา (Initial) หรือ t = 0
3.หาจา นวนโมลหรือ โมล/ลิตร ที่เปลี่ยนแปลงไป เนื่องจากเกิดปฏิกิริยาโดยกาหนดให้จา นวนโมลที่หายไปเป็นลบ (สารตัง้ ต้น) จา นวนโมลที่เพิ่ม ขึ้นเป็นบวก (สารผลิตภัณฑ์)
4.หาจานวนโมล หรือ โมล/ลิตร ณ จุดสมดุล (Final) หรือ t = te โดยนา ข้อ 2 + ข้อ 3ตามเครื่องหมายบวกลบนั้น ๆ แล้วเปลี่ยนจา นวนโมล ณ จุดสมดุลให้เป็นโมล/ลิตร แล้วจึงแทน ค่าความเข้มข้นในสมการค่า Kc
ลักษณะโจทย์ในการคา นวณค่าคงที่สมดุล
มีทั้ง หมด 4 แนวทาง
1. ให้หา ค่าคงที่สมดุล โดยกาหนดความเข้มข้นให้ทุกค่า
2. ให้หาค่าคงที่สมดุล โดยกาหนดความเข้มข้นให้บางค่า ส่วนค่าที่เหลือหาจากสมการเคมี
3. กาหนดค่าคงที่สมดุลให้ และหาความเข้มข้นของสารแต่ละตัว
4. การหาค่า K เมื่อมีการรบกวนสมดุล
แนวทางที่ 1 ให้หา ค่าคงที่สมดุล โดยกา หนดความเข้มข้นให้ทุกค่า
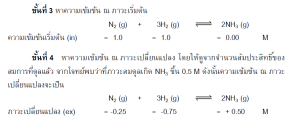
แนวทางที่ 2 ให้ค่า K โดยกา หนดความเข้มข้นให้บางค่า ส่วนค่าที่เหลือหาจากสมการ
ตัวอย่าง ที่อุณหภูมิ 700 องศาเซลเซียส เมื่อนา N2 จานวน 2.00 mol มาทาปฏิกิริยากับ H จำนวน 2.00 mol ในภาชนะปิด 2.00 ลิตร ภาวะสมดุลมีก๊าซแอมโมเนีย เกิดขึ้นจานวน 1.00mol จงหาค่า Kc
แนวทางที่ 3 กา หนดค่า K มาให้ และให้หาความเข้มข้นของสารแต่ละตัว
แนวทางที่ 4 การหาค่า Kc หรือหาความเข้มข้น เมือ่ มีการรบกวนสมดุล
ใช้หลักการที่ว่า ค่าคงที่ใหม่ เท่ากับค่าคงที่เดิม หรือ Kc ใหม่ = Kc เดิม
ตัวอย่าง ที่ 500 องศาเซลเซียส ณ ภาวะสมดุลของปฏิกิริยาในภาชนะขนาด 1.0 ลิตร มี ก๊าซA, B, C และ D เท่ากับ 4.0, 3.0, 2.0 และ 1.0 mol ตามลาดับ ถ้าเติม A 1.0 mol จงหาความเข้มข้นของสารต่าง ๆ ที่ภาวะสมดุลใหม่
วิธีทา
4.2 ค่าคงที่สมดุลของปฏิกิริยาของแก๊ส
ถ้าสารอยู่ในสถานะก๊าซการหาความเข้มข้นจะยุ่งยากกว่า ดังนั้นเพื่อความสะดวกจะทำ การวัดความดันมากกว่าความเข้มข้น ดังนั้นค่าคงที่สมดุลที่วัดจากความดัน คือ Kp
4.3 ค่าคงที่สมดุลของปฏิกิริยาวิวิธพันธ์
จากสมดุลที่ได้ศึกษามาแล้ว ได้แก่ สมดุลในสารละลาย สมดุลของแก๊ส พบว่าสารตั้งต้นและสารผลิตภัณฑ์ทุกชนิดมีสถานะเหมือนกัน สมดุลของปฏิกิริยานี้เรียกว่า สมดุลเอกพันธ์ (Homogeneous equilibrium) แต่อย่างไรก็ตามถ้าในบางสมดุลสารตั้งต้น และสารผลิตภัณฑ์ไม่ได้มีสถานะเดียวกัน สมดุลของปฏิกิริยานี้เรียกว่ า สมดุลวิวิธภัณฑ์ (Heterogeneous equilibrium) เช่นปฏิกิริยาการสลายตัวด้วยความร้อนของหินปูน (แคลเซียมคาร์บอเนต) ไปเป็นปูนดิบ (แคลเซียมออกไซต์)
รูป แสดงการสลายตัวของแคลเซียมคาร์บอเนตในช่วงต่างๆแต่มีอุณหภูมิเดียวกัน และวัดความดันของแก๊สคาร์บอนไดออกไซด์ที่เกิดขึ้นพบว่าที่สมดุลความดันมีค่าคงที่ทัง้ ในภาพ a และ b
(McMURRY, Chemistry 4th edition)
5. ประโยชน์ของค่าคงที่สมดุล
ค่าคงที่สมดุลบอกให้ทราบทิศทางการเกิดปฏิกิริยา การดำเนินไปของปฏิกิริยาว่าเกิดปฏิกิริยาได้มากน้อยเท่าใด และสามารถใช้คำนวณความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์
ที่ภาวะสมดุลได้ด้วย
5.1 ใช้ทานายว่าปฏิกิริยาเกิดมากน้อยเพียงใด
จะเห็นได้ว่าค่าคงที่สมดุลของปฏิกิริยานี้มีค่าสูงมาก นั่น คือที่ภาวะสมดุลมีผลิตภัณฑ์เกิดขึ้นมากและเหลือสารตั้ง ต้นอยู่น้อย แสดงว่าปฏิกิริยาดาเนินไปข้างหน้ากลายเป็นผลิตภัณฑ์ได้เกือบหมด
ในทางตรงกันข้าม เช่น ปฏิกิริยาย้อนกลับของการสลายตัวของน้า
จะเห็นได้ว่าค่าคงที่สมดุลของปฏิกิริยานี้มีค่าน้อยมาก นั่น คือที่ภาวะสมดุลมีผลิตภัณฑ์เกิดขึ้นน้อยมากและเหลือสารตั้งต้นอยู่มาก แสดงว่าปฏิกิริยาดาเนินไปข้างหน้ากลายเป็นผลิตภัณฑ์ได้น้อย
แต่จากตัวอย่างข้างต้นจะเห็นได้ว่า ค่าคงที่สมดุลที่กาหนดให้มีค่าค่อนข้างชัดเจนสามารถพิจารณาได้ง่าย แต่สำหรับบางปฏิกิริยาที่ค่าคงที่สมดุลไม่มีค่าที่ชัดเจนมาก
มีหลักเกณฑ์พิจารณาดังนี้